Ergänzung 7.3: Raman-Streuung (2/6)
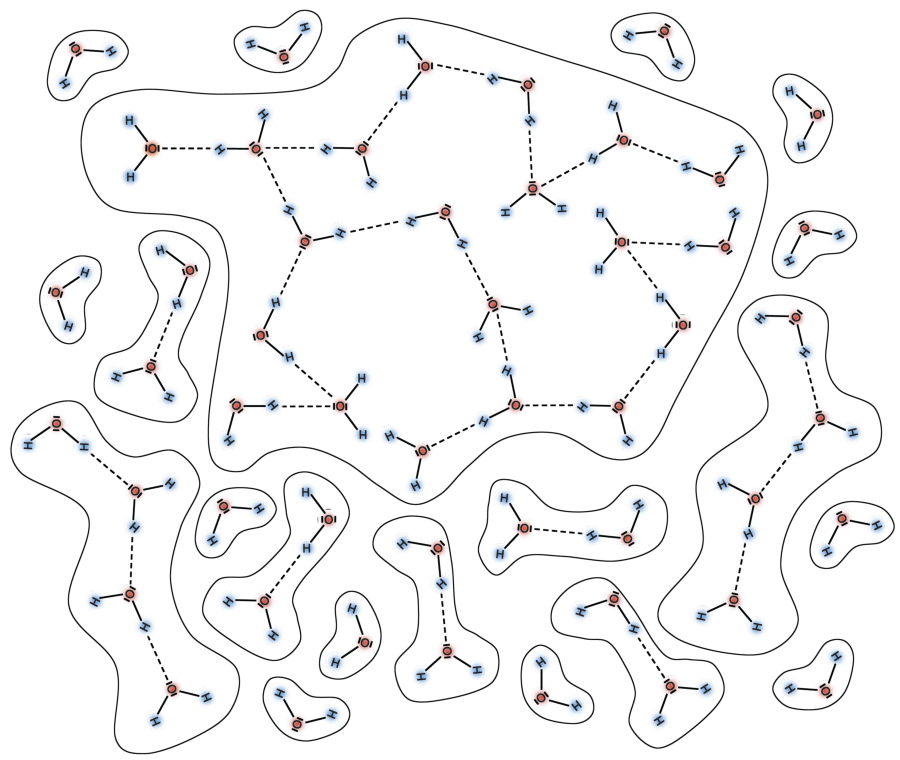
Wasserstoffbrücken
Moleküle, die ein permanentes Dipolmoment besitzen, erzeugen elektrische Anziehungskräfte zu anderen Molekülen in ihrer unmittelbaren Umgebung. Im Fall des Wassermoleküls sind dies die Wasserstoffbrückenbindungen. Zwei durch eine Wasserstoffbrücke gebundene Wassermoleküle sind im folgenden Bild gezeigt.
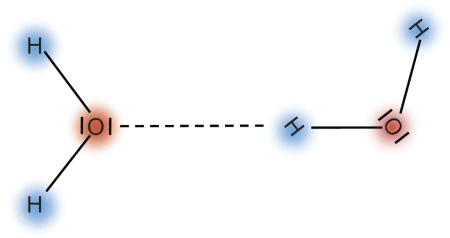
Die Bindungsenergie der Wasserstoffbrücken ist nur etwa 1% der Bindungsenergie des Sauerstoffatoms an eines der Wasserstoffatome im Wassermolekül. Daher sind die Wasserstoffbrücken nicht sehr stabil: sie bilden sich ständig neu und zerfallen wieder nach sehr kurzer Zeit. Trotzdem sind sie für die Eigenschaften des Wassers ganz entscheidend: wegen der Wasserstoffbrücken ist Wasser bei Raumtemperatur flüssig. Viele Moleküle sind mit Wasserstoffbrücken zu großen Aggregaten verbundenen und entsprechen eher einem Polymer (man bezeichnet sie auch als Cluster). Verdunstet das flüssige Wasser, dann treten Einzelmoleküle aus der flüssigen Phase aus und gehen in die Gasphase über. Wasserdampf besteht ganz überwiegend aus Einzelmolekülen, dann ist das Wasser ein Monomer.
Mit steigender Temperatur des flüssigen Wassers nimmt die Zahl und Größe der Cluster ab. Die Cluster haben verglichen mit einzelnen freien Molekülen wegen der großen Bindungslänge der Wasserstoffbrücken einen hohen Raumbedarf. Mit steigender Temperatur nimmt andererseits die thermische Eigenbewegung der Moleküle zu; sie benötigen dann wesentlich mehr Raum, dies ist die für alle Stoffe bekannte Wärmeausdehnung. Beide Effekte überlagern sich im flüssigen Wasser und führen zu einem Dichtemaximum (bzw. einem Minimum des spezifischen Volumens) bei 4°C.
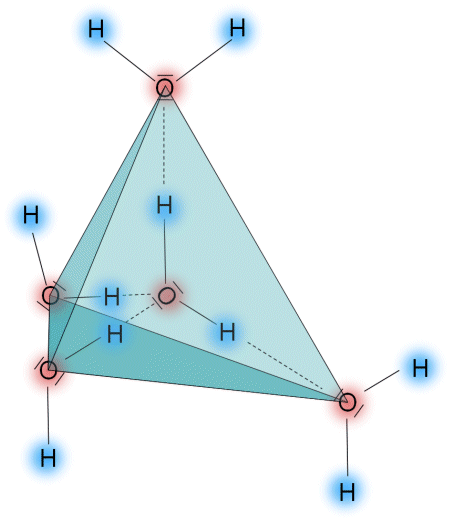
Gefriert Wasser zu Eis, dann verbinden sich alle Moleküle mit Wasserstoffbrücken. Jedes Sauerstoffatom ist im Molekül mit zwei Wasserstoffatomen gebunden, bildet aber zwei zusätzliche Wasserstoffbrücken zu Sauerstoffatomen benachbarter Moleküle aus. Die sich so ergebenden Struktur - sie ist im folgenden Bild gezeigt - erfordert viel Platz, weshalb sich das Wasser beim Gefrieren um etwa 10% ausdehnt. Entsprechend ist die Dichte von Eis etwa 10% kleiner als die Dichte des flüssigen Wassers.
Zum Vergleich: das ebenfalls dreiatomige Kohlendioxid mit dem Formelzeichen: O=C=O ist symmetrisch um seine Längsachse aufgebaut und nicht gewinkelt, und besitzt daher kein permanentes Dipolmoment. Daher treten keine zwischenmolekularen Kräfte auf und Kohlendioxid ist - anders als das Wasser - bei Raumtemperatur und Atmosphärendruck gasförmig.