Ergänzung 7.2: Fluoreszenz (1/2)
Was ist Fluoreszenz?
Wir betrachten elektromagnetische Strahlung, die auf Materie trifft und teilweise absorbiert wird. Findet infolge der Absorption nach einer sehr kurzen Zeit von etwa 1 Nanosekunde eine Emission von Strahlung bei der gleichen oder einer höheren Wellenlänge statt, so wird dies als Fluoreszenz bezeichnet. Findet die Emission erst nach längerer Zeit (Mikrosekunden ... Sekunden ... Minuten) statt, so bezeichnet man sie als Phosphoreszenz. Fluoreszenz und Phosphoreszenz kann bei Gasen, Flüssigkeiten und Festkörpern auftreten.
Hier wird das Photonenmodell des Lichts genutzt, da es für das Verständnis geeigneter ist als das Modell des Lichts als elektromagnetische Welle: die Photonenenergie (Plancksches Wirkungsquantum h, Frequenz f der elektromagnetischen Welle) kann direkt mit den Energieänderungen von Elektronen bei Übergängen zwischen diskreten Energieniveaus verglichen werden. Die Modelle des Lichts als Welle und Teilchen sind in der SEOS-Lerneinheit Spektren der Erde ausführlich dargestellt.
Fluoreszenz von Atomen
Werden Atome mit Photonen beleuchtet, deren Energie gleich dem Energieabstand zweier diskreter Elektronenzustände ist, so findet Absorption statt. Das vom Zustand in das Niveau überführte Elektron geht anschließend wieder in den Zustand zurück, wobei ein Photon gleicher Energie emittiert wird. Es gibt keine Vorzugsrichtung für das emittierte Photon. Frequenz und Wellenlänge des absorbierten und emittierten Lichts sind identisch, daher wird dies als Resonanzfluoreszenz bezeichnet. Absorption und Emission wurden bereits in Kapitel 2 diskutiert.
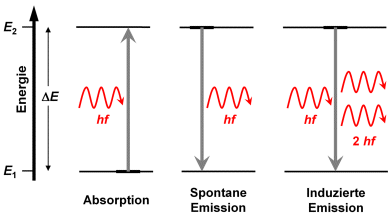
Da Atome sehr viele Elektronenniveaus bei unterschiedlichen Energien besitzen, kann der Übergang eines Elektrons von eimen angeregten Zustand in den Grundzustand auch über Zwischenniveaus stattfinden. Dann ist die Energie der emittieren Photonen entsprechend kleiner als die Energie der absorbierten Photonen. Diese Fluoreszenz ist daher keine Resonanzfluoreszenz. Die Energie der Fluoreszenzphotonen ist daher immer kleiner oder maximal gleich der Energie der absorbierten Photonen, die Wellenlänge des Fluoreszenzlichts entsprechend größer oder gleich derjenigen des absorbierten Lichts.
Zustände von Molekülen
Moleküle sind Verbände von Atomen, zwischen denen Kräfte wirken. Diese Kräfte sind insgesamt ausreichend bindend, um Moleküle nach außen als Einheit erscheinen zu lassen. Sie können aus sehr vielen Atomen bestehen, bei Makromolekülen aus bis zu 104...106 Atomen.
Wir betrachten ein zweiatomiges Molekül als den einfachst möglichen Fall, mit einem Abstand ro der beiden Atome. Sowohl anziehende wie abstoßende Kräfte müssen vorliegen, die sich im Abstand ro kompensieren. Für kleinere Abstände tritt eine Abstoßung auf, die dadurch zustande kommt, dass sich die inneren Elektronenschalen überlagern, aber keine gemeinsamen Elektronenzustände möglich sind (Coulomb-Abstoßung). Für größere Abstände überwiegen Anziehungskräte durch die gemeinsamen bindenden Elektronen (Coulomb-Anziehung). Beide Effekte zusammen führen zu einem Energieverlauf mit einem Minimum bei ro.
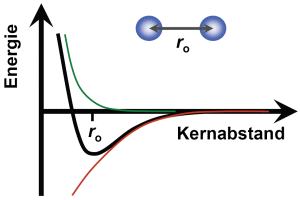
Wie bei Atomen kann eines der äußeren Elektronen durch Photonen in ein höheres Energieniveau gebracht werden. Im angeregten Zustand ist der Verlauf der Energie in Abhängigkeit vom Abstand der Atome ähnlich wie im Grundzustand. Der Gleichgewichtsabstand der Atome ist jedoch größer, da die Molekülbindung im angeregten Zustand schwächer ist.
Eine wichtige Eigenschaft der Elektronen ist der Spin, der bei Experimenten mit Elektronen wie der Drehimpuls einer um ihre Schwerpunktachse rotierenden Kugel erscheint (Elektronen sind allerdings keine Kugeln, sondern punktförmige Teilchen, daher kann man sich kein anschauliches Bild vom Spin machen). Der Elektronenspin ist quantisiert, doie Spin-Quantenzahl s kann nur die benden Werte ±½ annehmen (um das eigentlich nicht gültige Bild einer Kugel nochmals zu benutzen: sie rotiert im Uhrzeigersinn und entgegengesetzt zum Uhrzeigersinn). Da der Spin der bindenden Elektronen im Grundzustand entgegengesetzt ('antiparallel') orientiert ist, bleibt dies auch im angeregten Zustand so. Der Zustand antiparalleler Spins zweier Elektronen wird als Singulett bezeichnet.
Es kann jedoch - beispielsweise durch einen Stoß mit einem anderen Atom oder Molekül - eintreten, dass das angeregte Elektron seinen Spin 'umklappt'. Dann ist der Spin der bindenden Elektronen gleichgerichtet ('parallel'). Der Zustand paralleler Spins zweier Elektronen wird Triplett genannt. Elektronen im Triplett-Zustand können nicht direkt in den (Singulett-)Grundzustand zurückkehren, da der Spin des angeregten Elektrons wiederum umklappen muss. Da dies nicht von alleine geschieht, sondern ebenfalls einen Stoß mit einem anderen Teilchen voraussetzt, sind Triplett-Zustände sehr langlebig.
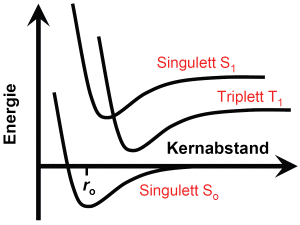
Beim Übergang des angeregten Elektrons in den Grundzustand wird - wie bei den Atomen - ein Photon emittiert. Vom angeregten Singulett-Zustand aus kann dies sehr schnell geschehen, das Molekül fluoresziert. Vom Triplett-Zustand aus erfordert es längere Zeit, das M;olekül phosphoresziert. Manche Moleküle haben eine besondere Struktur und gehen bei einer Anregung bevorzugt in einen Triplett-Zustand; solche Stoffe werden als Phosphore bezeichnet.
